Bei Patientinnen und Patienten mit Stoffwechselkrankheiten verursachen erhöhte Blutfettwerte Stress in den Muskelzellen – eine Reaktion auf Veränderungen außerhalb der Zelle. Ein internationales Forschungsteam unter Federführung der University of Leeds und mit Beteiligung der Universität Bonn hat herausgefunden, dass diese gestressten Zellen ein Signal aussenden, das an andere Zellen weitergegeben werden kann. Diese Signale, die als Ceramide bekannt sind, können kurzfristig einen schützenden Effekt haben, da sie Teil eines Mechanismus sind, der den Stress in der Zelle verringern soll. Bei langfristig auftretenden Stoffwechselkrankheiten können die Signale jedoch die Zellen abtöten, die Symptome und die Krankheit verschlimmern. Die Studie ist im Fachjournal Nature Communications erschienen.
Es ist seit langem bekannt, dass ein erhöhter Fettgehalt im Blut das Gewebe und die Organe schädigt und zur Entstehung von Herz-Kreislauf- und Stoffwechselkrankheiten wie Typ-2-Diabetes beiträgt. Die Erkrankung kann durch Fettleibigkeit verursacht werden, deren Raten sich seit 1975 weltweit fast verdreifacht haben. Im Jahr 2016 waren mehr als 650 Millionen Erwachsene im Alter von 18 Jahren und älter fettleibig.
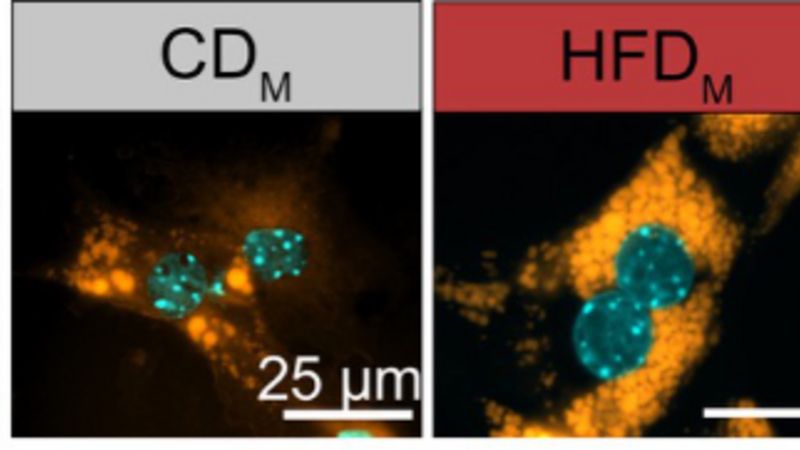
Das Forschungsteam replizierte im Labor die bei Menschen mit Stoffwechselkrankheiten beobachteten Blutfettwerte, indem es Skelettmuskelzellen einer Fettsäure namens Palmitinsäure aussetzte. Die Zellen begannen, die Palmitinsäure in Ceramid umzusetzen und als Ceramid-Signal zu übertragen. Wurden diese Zellen mit anderen gemischt, die zuvor nicht mit Fetten in Berührung gekommen waren, stellten die Forschenden fest: Die Zellen kommunizierten miteinander und transportierten das Ceramid-Signal in Paketen, sogenannten extrazellulären Vesikeln.
Das Experiment wurde an Freiwilligen mit Stoffwechselkrankheiten wiederholt und ergab vergleichbare Ergebnisse. „Die Ergebnisse bieten einen völlig neuen Blickwinkel auf die Art und Weise, wie Zellen auf Stress reagieren, mit wichtigen Konsequenzen für unser Verständnis bestimmter Stoffwechselkrankheiten, einschließlich Fettleibigkeit“, sagt Dr. Reinhard Bauer vom Forschungsinstitut LIMES (Life and Medical Sciences) der Universität Bonn, Mitglied im Transdisziplinären Forschungsbereich „Leben und Gesundheit“.
Neuer Blickwinkel auf Zellstress
Seine Forschungsgruppe arbeitet mit einem Mausmodell, bei dem das Ceramid-Signal aufgrund einer Mutation stark reduziert ist. Wurden die Skelettmuskelzellen der Mäuse mit der Palmitinsäure gestresst, konnte das Ceramid-Signal nicht mehr entstehen und in Nachbarzellen transportiert werden. So konnten die Forschenden Daten aus den zellbasierten sowie den humanen Studien kombinieren und verifizieren.
Forschungsleiter Lee Roberts, Professor für Molekularphysiologie und Stoffwechsel an der School of Medicine der University of Leeds, unterstreicht: "Obwohl sich diese Forschung noch in einem frühen Stadium befindet, könnte unsere Entdeckung die Grundlage für neue Therapien oder therapeutische Ansätze bilden, um die Entwicklung von Herz-Kreislauf- und Stoffwechselkrankheiten wie Diabetes bei Menschen mit erhöhten Blutfetten bei Fettleibigkeit zu verhindern."
„Die Studie zeigt uns eine neue Perspektive darauf, wie sich Stress in den Zellen von Menschen mit Fettleibigkeit entwickelt, und bietet neue Wege, die für die Entwicklung neuartiger Behandlungen von Stoffwechselkrankheiten in Betracht gezogen werden können“, sagt Lea Hänschke, Doktorandin am LIMES-Institut. Dies ist von hoher Relevanz, da Fettleibigkeit ein weltweit wachsendes Problem darstellt und die damit verbundenen chronischen Krankheiten wie Typ-2-Diabetes neue Behandlungen erfordern.
Beteiligte Institutionen:
An der internationalen Studie waren neben den Universitäten Leeds und Bonn die Universitäten Cambridge und Bari, das Imperial College London sowie das Unternehmen AstraZeneca beteiligt.
Publikation: Ben D. McNally, Dean F. Ashley, Lea Hänschke, Hélène N. Daou, Nicole T. Watt, Steven A. Murfitt, Amanda D. V. MacCannell, Anna Whitehead, T. Scott Bowen, Francis W. B. Sanders, Michele Vacca, Klaus K. Witte, Graeme R. Davies, Reinhard Bauer, Julian L. Griffin & Lee D. Roberts: Long-chain ceramides are cell non-autonomous signals linking lipotoxicity to endoplasmic reticulum stress in skeletal muscle. Nature Communications; DOI: https://doi.org/10.1038/s41467-022-29363-9
KONTAKT:
PD Dr. Reinhard Bauer
Forschungsinstitut LIMES der Universität Bonn
Tel.: +49 228 7362744
E-Mail: r.bauer@uni-bonn.de