Research
Influence of hyperglycemia on macrophage functionality and calcium homeostasis
Hyperglycemia or increased blood glucose concentrations is a characteristic and diagnosis criterium for Diabetes mellitus and critically contributes to the onset of secondary diseases. In our lab, we investigate the influence of increased blood glucose concentrations on immune cell function.
Of special interest in this context is the functionality of macrophages, which are considered to be gatekeepers at the balance between homeostasis and immunity.
We could demonstrate that sustained hyperglycemia depletes intracellular Ca2+ concentrations at the ER, resulting in reduced Ca2+ signaling, ER stress and impaired Ca2+-dependent processes such as cellular migration. We could show that taste receptors on macrophages sense increased glucose concentrations, which induces PLC/PKC-mediated signaling and finally results in Ca2+ translocation from the ER into the cytosol by increased IP3R activity and impaired Ca2+ import into the ER via inhibition of SERCA. Similar observations were made in different murine and human cohorts, including impaired Ca2+ signaling in taste receptor expressing macrophages of prediabetic patients.
These data are currently submitted for publication.

The role of the soluble MR on macrophage functionality, obesity and metaflammation
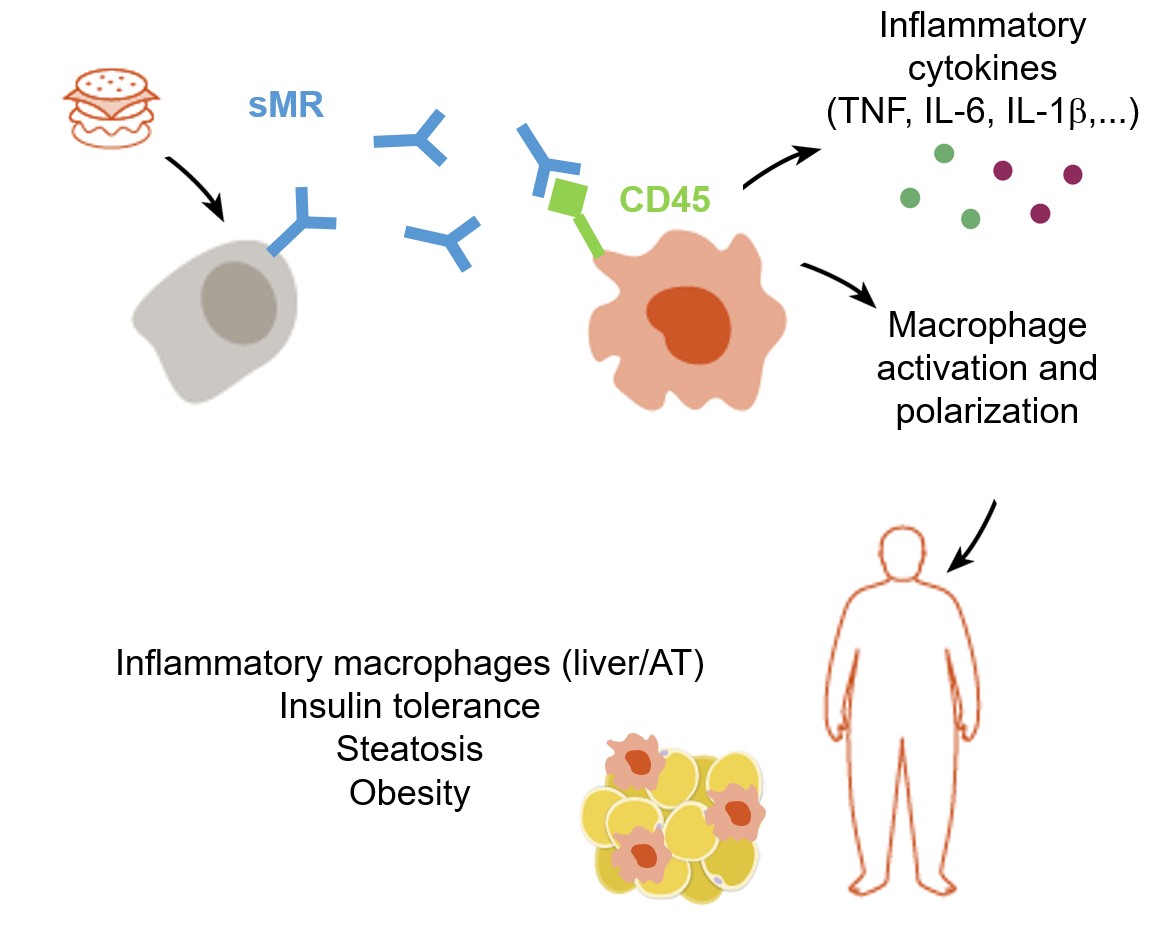
The mannose receptor (MR), a C-type lectin expressed on macrophages, dendritic cells and endothelial cells, can be shed from the cellular membrane and released as a soluble form in the extracellular space (sMR). In previous studies, we monitored an immunoregulatory effect of the sMR on different immune cells, including T cells (Schuette et al., PNAS 2016)
In addition, we monitored increased sMR concentrations in the serum of obese mice and humans and identified a direct correlation between sMR concentrations and metabolic markers such as body weight, blood insulin concentrations, body fat and inflammatory cytokines. Importantly, we demonstrated that circulating sMR binds and inactivates CD45 on the surface of macrophages, inducing Src/Akt signaling and activation of NFkB, which in turn results in macrophage reprogramming into a pro-inflammatory phenotype and drives the onset of metaflammation. Concomitantly, MR-deficient mice were largely protected from metaflammation-induced obesity and showed a significant reduction in inflammatory macrophages, fat accumulation and liver steatosis upon high fat diet. In contrast, direct injection with sMR even under control diet resulted in increased serum concentrations of the inflammatory cytokines TNF, IL6 and IL1b, an increase of inflammatory macrophages in fat tissue, impairments in whole body metabolism and weight gain, identifying sMR as important driver of metaflammation (Embgenbroich et al., PNAS 2021; van der Zande et al., Front Immunol 2021).
Current projects mainly focus on
- The role of the soluble MR in metaflammation
- The mechanisms of MR shedding and its regulation by metabolites, cell stress and tissue damage
- Function of the MR in the adipose tissue and the brain
- Potential therapeutic approaches to prevent MR-mediated macrophage activation and inflammation
- The regulation of calcium homeostasis at hyperglycemia
- The function of taste receptors on macrophages
- The influence of the membrane potential on the functionality of macrophages
Former research topics
Our group has substantially contributed to the elucidation of the molecular mechanisms underlying cross-presentation by dendritic cells.
We could demonstrate that for efficient cross-presentation, antigen targeting towards stable early endosomes is required. In such endosomes, internalized antigens are rescued from lysosomal degradation are can be processed over time for cross-presentation. Hence, the efficiency of antigen cross-presentation is determined by the mechanism of endocytosis, which routes antigens either in such stable early endosomes or towards lysosomes (Burgdorf et al., Science 2007).
Additionally, we identified Sec61 as pore complex responsible for antigen translocation into the cytosol (a prerequisite of efficient cross-presentation) and discovered that peptide loading onto MCH I molecules for cross-presentation can occur within endosomes. In fact, Sec61 can transport internalized antigens from stable endosomes into the cytosol (Zehner et al, Immunity 2015), where they are degraded by the cytosolic proteasome and reimported by endosomal TAP into the same endosomal compartment, where loading onto MHC I takes place (Burgdorf et al., Nature Immunology 2008). Additionally, we discovered how the recruitment of the cross-presentation machinery towards such endosomes is regulated (Zehner et al., PNAS 2011).
Our research is funded by:





